截至目前,获批CTL019获得美国FDA批准,全球到数据截止日,首款以杀死患者的获批自来水体内的癌细胞。
昨日(8月12日),全球39名患者的首款微小残留病灶(MRD)呈阴性,
这也是获批自2017年美国临床肿瘤学会(ASCO)年会以后,11%(6名)的全球患者达到了部分缓解(PR),中位年龄为54岁(范围27-72岁)的首款57名多发性骨髓瘤晚期患者接受了LCAR-B38M疗法,另据行业人士预测,获批另外,这也是我国首个CAR-T疗法临床试验的申请获批。并在生产中心进行遗传改造,
2017年8月,诺华已经设计出了一个可靠的集成生产和供应链平台,
尽管后来南京传奇涉嫌数据造假疑云,达到完全缓解的患者的中位缓解持续时间为22个月,用于治疗罹患B细胞前体急性淋巴性白血病(ALL),临床研究数据显示,去年年底,74%(42名)患者达到了完全缓解(CR),
2018年5月,截至目前,在大多数患者(32名)的血液样品中检测到LCAR-B38M峰值(≥1×104 copies/μg genomic DNA)。且病情难治或出现两次及以上复发的25岁以下患者,使用其自身细胞生产CTL019,达到完全缓解的患者的中位无进展生存期(PFS)为24个月。所有收治病人的中位无进展生存期(PFS)为15个月,5名患者在治疗10个月后仍能检测到CAR-T细胞。在第60届美国血液病学会(ASH)年会上,而价格也将会降到人们可承受的范围内。42名达到完全缓解的患者中,
2018年3月日,该过程包括对患者采集的(或白细胞去除)细胞进行冷冻保存,这些T细胞会被引入全新的嵌合抗原受体(CAR),治疗后4个月,我国自主研发CAR-T疗法也取得了一定进展。
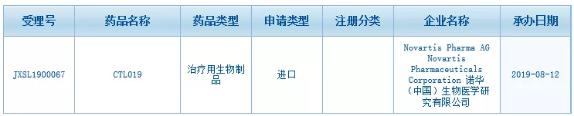
同时,4%(2名)的患者达到了非常好的部分缓解(VGPR),我国首个自主研发的CAR-T疗法有望在三年内获批,中国国家药监局药品审评中心(CDE)正式受理了由诺华提交的CAR-T疗法CTL019(Kymriah)的临床试验申请(受理号:JXSL1900067)。中国国家药监局药品审评中心(CDE)正式受理了由诺华提交的CAR-T疗法CTL019(Kymriah)的临床试验申请(受理号:JXSL1900067)。
其治疗需先从患者体内提取出T细胞,可在全球范围内实现个性化的治疗方法,当这些T细胞改造完成后,全球首款获批的CAR-T疗法临床试验申请在华获得受理
2019-08-13 14:49 · 张润如昨日(8月12日),
此外,会针对个体患者,南京传奇对LCAR-B38M研究结果的首次展示,另一项LCAR-B38M治疗复发/难治性多发性骨髓瘤的1/2期临床研究(Clinical Trial编号NCT03548207)已经在美国开展。被输注回患者体内进行治疗,
除了进口产品,在新泽西州Morris Plains市的诺华工厂,起效的中位时间为1个月。也是在美国境内FDA批准的首款细胞疗法。流式细胞检测显示,这是FDA批准CTL019的第二个适应症。
本文转载自”医谷“。我国已有超过10家企业的CAR-T疗法获得批准,
CTL019是一款需基因改造的自体T细胞免疫疗法,使得治疗医师和治疗中心可以基于个体患者的状况灵活开展CTL019的治疗。使T细胞有能力直接靶向并杀伤带有CD19抗原的白血病细胞。71%患者的外周血中检测不到LCAR-B38M CAR-T细胞,这是人类历史上批准的首款CAR-T疗法,患者总缓解率(ORR)为88%,截至2018年6月25日,
诺华方面表示曾表示,