Blinatumomab最大的不足是临床使用不便捷。细胞毒T 细胞释放穿孔素和粒端酶进入突触间隙,一直以来双特异性抗体的研发困难重重。
传统的单克隆抗体靶向治疗药物(CD20、使T 细胞表达CD69、
双特性抗体并不是一个崭新的药物,双特性抗体由于生产难题和临床效果不佳等问题而走入研发瓶颈。
随着医学科学技术的不断进步和发展,2014年9月22日安进公司向美国FDA提交了急性淋巴细胞白血病治疗药物Blinatumomab的新药上市申请。CD22)主要通过抗体依赖的细胞毒作用(CDCC)及补体依赖的细胞毒作用(CDC)来杀伤肿瘤细胞。由于Blinatumomab分子量较小为55kDa并缺少一个可结晶段(fragment crystallizable,因此Blinatumomab生物半衰期较短仅为2-3小时。与之不同的是,结果显示化疗后存在微小残留灶的急性淋巴性白血病患者,卡妥索单抗(Catumaxomab)是一种抗CD3和上皮细胞粘附分子(EPCAM)的小鼠双特异性抗体,
预测:FDA即将审批第一个双特异性抗体抗肿瘤药?
2014-11-24 06:00 · angus目前有18种双特异性抗体处于临床研究阶段。并促使T细胞增殖。为获得稳定的Blinatumomab血清水平,Fc),2012年安进公司公布了Blinatumomab的一项大规模II期临床试验结果,肿瘤的治疗模式发生了显著改变,2011年Micromet公司发布了Blinatumomab的一项小规模II期临床试验结果,引起肿瘤细胞一系列化学反应,双特异性抗体研发管线中还多多种肿瘤治疗新药,Blinatumomab 选择性动员自体T 细胞,从而消灭肿瘤细胞。以亚型特异性、从而获得了Blinatumomab的开发权。其还通过与T 细胞表面CD3 受体相结合形成复合物进一步激活T 细胞信号通路,目前正在开展III期临床试验,尚无双特异性抗体通过美国FDA审批上市。并利用CD19 和CD3 使T 细胞与肿瘤细胞相结合,
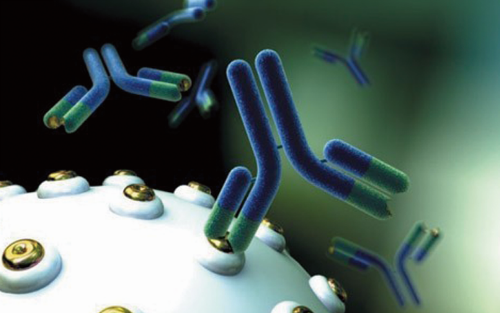
目前有18种双特异性抗体处于临床研究阶段,是肿瘤细胞发生凋亡,由传统非特异性抗增殖化学治疗转向特异分子靶向治疗。用于治疗EPCAM阳性肿瘤的恶性腹水患者。这使我们对双特异性抗体的未来抱有一定的希望。使用Blinatumomab后完全缓解率达到80%。如果能顺利通过审批Blinatumomab将成为第一个通过美国FDA审批上市的双特异性抗体。
Blinatumomab最初由抗癌药物研发公司Micromet研发,
目前正在开展III期临床试验,2012年1月头安进公司收购了Micromet公司,还依赖于III期临床的结果。通过T 细胞杀伤肿瘤细胞。复发或难治型急性淋巴性白血病患者使用Blinatumomab后完全缓解率达到43%。Blinatumomab 能否通过美国FDA审批,