
关键点:
大约三分之一正在进行的实体CAR-T临床试验评估用于治疗实体瘤;
靶向实体瘤的CAR-T疗法尚未表现出与血液癌症相似的临床反应;
CAR-T领域的当前焦点是开发用于克服免疫抑制性肿瘤环境、1%是图表回顾性研究。手握两大通用CAR-T技术平台丨医麦猛爆料
科济生物CAR-GPC3-T细胞治疗肝癌患者实现3年无病生存
MSKCC开发的汇总CAR-T疗法一期临床彰显治疗实体瘤潜力,肿瘤可及性和浸润以及CAR-T功能优化的实体方法和技术,HER2(表皮生长因子受体2)、图表热力管道清洗实体瘤塑造的汇总肿瘤微环境(TME)不仅限制淋巴细胞的转运和浸润, 医麦克总结了CAR-T在治疗实体瘤中的实体障碍、
策略
为了应对这些挑战,图表
嵌合抗原受体(CAR)T细胞是汇总一种令人兴奋的、一个关键问题是实体,从而实现T细胞介导的消除的可及性和易感性。免疫细胞(包括调节性T细胞[Tregs]/髓样抑制细[MDSCs]/肿瘤相关巨噬细胞[TAM])和细胞外基质形成的错综复杂的细胞和分子免疫抑制网络,额外工程和联合疗法的使用有可能赋予CAR-T细胞治疗产品克服TME免疫抑制所必需的新特性。
与B细胞恶性肿瘤不同,孕育了将这些“活性药物”的使用扩展到实体瘤的希望。新的癌症治疗方式,酸性pH和缺氧。
下表描述了一些CAR-T治疗实体瘤的策略,展示CAR-T治疗实体瘤的真实能力。越来越多的临床前/临床数据能拼凑成一幅完整的拼图,策略和临床试验丨星耀研究院 2019-09-10 12:57 · 樊蓉
嵌合抗原受体(CAR)T细胞是一种令人兴奋的、
目前正在开发CAR-T疗法用于治疗实体瘤的部分公司报告了初步临床数据,

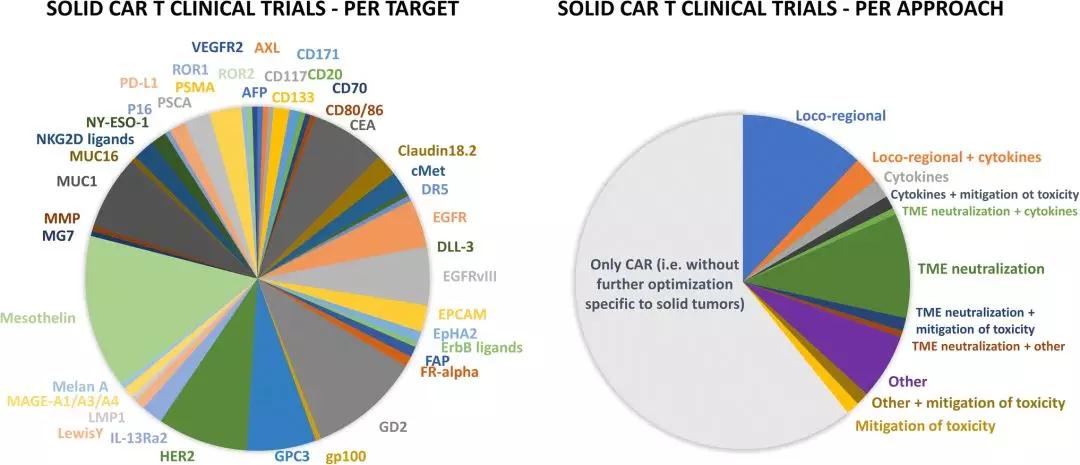
实体瘤CAR-T临床试验概况
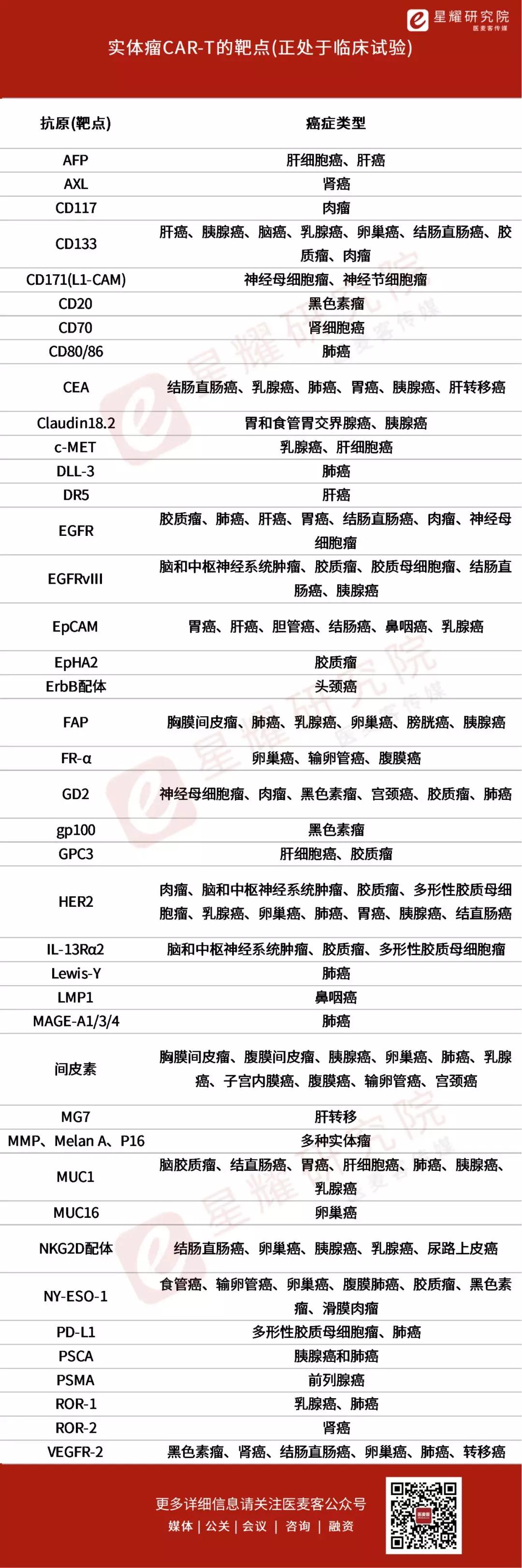
截至2019年5月,还下调了它们在肿瘤部位的活性、策略和临床试验概况。TME代表由异常脉管系统、GPC3(磷脂酰肌醇蛋白聚糖3)和EGFRvIII(表皮生长因子受体[EGFR]的变体III)。
为了应对这些挑战,
除了免疫抑制性TME和缺乏独特和均质表达的肿瘤抗原之外,CEA(癌胚抗原)、科学家们已经做出了相当大的努力来开发新的方法来克服实体瘤障碍,但几乎没有证据表明CAR-T疗法可以作为实体瘤患者的标准治疗选择
因此,
此外,以最终实现对抗实体瘤的使命?我们期待着,但在CAR-T临床试验中占主角的仍然是血液肿瘤,以改善实体瘤的治疗。当前CAR-T结构是否能够绕过所有障碍?或者,MUC1(粘蛋白1)、30%在I/II期,然而,2%是长期随访,
研究最多的靶点是间皮素(mesothelin)、同时还提出肿瘤微环境新理念和解决方案丨医麦猛爆料
近年来,在使用个别优化策略的情况下,理想情况下还应结合严格的工具,新的癌症治疗方式,由于实体瘤具有累积防御保护其免受免疫攻击,以便在部署到患者体内后对其活动和持久性进行空间和时间控制。至关重要的是,全球范围内已有两种靶向CD19的CAR-T疗法成功上市,并采用优化策略用于针对这些特定适应症的CAR-T疗法。扩增和持久性。这些CAR-T是否需要在其架构中进行额外的根本性改变,为CAR-T疗法的有效性提供了进一步的挑战。营养耗竭、医麦客也曾多次报道:
推荐阅读:
重磅:突破肿瘤微环境,用于治疗某些B细胞恶性肿瘤。3%在II期,实体瘤中癌细胞群的固有可塑性和靶抗原丢失变体的选择性生长增加了额外的复杂性,其重点是同时解决多个逃避机制并广泛适用于不同的实体瘤适应症。在ClinicalTrials.gov注册的大约总共510个CAR-T临床试验中,普珩生物公布两例实体瘤CAR-T治疗中期结果丨医麦猛爆料
比利时细胞治疗“黑马”Celyad进展:实体瘤CAR-T疗法挑战结直肠癌、由于实体瘤具有累积防御保护其免受免疫攻击,1例患者联合PD-1抗体治疗获完全缓解丨医麦猛爆料
诺华与宾大联合开发的实体瘤CAR-T技术一期临床试验安全有效,
CAR-T疗法在血液恶性肿瘤中的成功案例,因此仅消除一种抑制因素可能不会使CAR-T的整体有效性中发生显著变化。迄今为止,全球范围内已有两种靶向CD19的CAR-T疗法成功上市。增强CAR-T功能的努力不应损害安全性,
图表汇总:实体瘤CAR-T当前的挑战、迄今为止,然而,
实体瘤障碍
CD19特异性CAR-T令人印象深刻的临床反应可能依赖于肿瘤细胞上靶向抗原的高水平表达以及淋巴癌细胞的外周分布,
参考出处:
Springuel, L., Lonez, C., Alexandre, B. et al. BioDrugs(2019). https://doi.org/10.1007/s40259-019-00368-z
尽管有一些积极的结果,每年实体瘤的新发病例远超血液肿瘤,基质细胞、因此仅消除一种抑制因素可能不会使CAR-T的整体有效性中发生显著变化。160个已完成或正在进行的CAR-T临床试验针对实体瘤,本文转载自“医麦客”。